Marquages fluorescents dans des fibroblastes de souris
La biologie cellulaire est un domaine assez actif et ce malgré le peu de crédits accordés à ce domaine.
Les enjeux sont pourtant de taille, tant en immunologie que pour la recherche contre le cancer et pour la compréhension de tout phénomènes in vivo.
Je vous parlais il y a peu de la timide émergence de la RMN in vivo. Cependant, d'autres techniques ont fait leurs preuves en biologie cellulaire, avec leurs avantages et leurs inconvénients. L'une d'elle, le marquage de protéines par fluorescence est très utilisée et permet d'obtenir des informations sur la localisation et l'organisation de protéines à l'intérieur de la cellule.
Je ne parlerai pas ici de techniques un peu plus poussées telles que le FRAP ou le FRET mais de simples marquages fluorescents.
Plusieurs techniques permettent de rendre des protéines intracellulaires fluorescentes, Eddy nous parlais de biologie moléculaire et d'expression de gène codant pour des protéines fluorescentes se trouvant sur des plasmides.
Ici, nous parlerons de marquages sur des cellules fixées, c'est à dire figées dans un état particulier, mortes, et marquées.
Ce genre de technique permet d'étudier une protéine à différents stades du cycle de vie de la cellule ou en réponse à différents stress.
Nous allons marquer l'actine d'une part avec de la phalloïdine, et la tubuline ainsi que la vimentine d'autre part, par immunomarquage.
Protocole
Afin d'obtenir de belles images, il nous faut déjà, comme vous l'avez deviné, de belles cellules.
Ici, nous utilisons des fibroblastes de souris qui ont la particularité d'être adhérentes, c'est à dire qu'elle vont se fixer au support - la matrice extracellulaire - et vont s'étaler. Elles ne seront donc pas rondes mais aplaties, un peu comme une amibe.
On a donc des cellules, maintenant, procédons étape par étape, mais vous en connaissez déjà certainement beaucoup :
• Fixation
Cette étape consiste à figer les cellules dans un état particulier, en gardant leur forme, leur organisation et leurs protéines intactes.
Pour cela deux solutions, pour nos marquage de l'actine, on utilise du paraformaldéhyde - PFA - qui est une molécule capable de polymériser et de créer un réseau réticulé dense dans lequel toutes les protéines et les membranes sont figées.
Pour nos immunomarquages, on place nos cellules à -20°C dans de l'éthanol.
L'action de l'alcool et du froid va figer les protéines et les membranes grâce à une déshydratation efficace.
De plus, cette méthode va aussi perméabiliser les membranes, étape essentielle comme nous allons le voir.
• Perméabilisation
Afin que nos marqueurs puissent entrer dans nos cellules, il faut que les membranes deviennent perméables.
En effet, la bicouche lipidique de celles-ci forme une barrière sélective très efficace, même lorsque les cellules sont mortes.
Comme nous l'avons vu, l'éthanol et la froid contribue déjà à perméabiliser les membranes, ainsi, nos cellules destinées à l'immunomarquage ont déjà validées cette étape.
En ce qui concerne les autres, on utilise un détergent, le Triton, afin de permettre à nos marqueurs de pénétrer.
• Saturation
Marquer des protéines c'est bien, marquer les bonnes c'est mieux.
Afin d'éviter que tout et n'importe quoi ne soit marqué, il faut saturer nos cellules. En effet, les marqueurs que nous allons utiliser ont beau être spécifiques des protéines que nous voulons étudier, il est possible qu'ils viennent se loger là où on ne les veut pas.
On utilise donc des protéines sans rapport avec l'expérience afin de "combler les espaces vides".
On met parfois du lait pour cela, ou bien ont utilise de la BSA, Albumine de Sérum Bovin.
• Marquage
Enfin la partie qui nous intéresse. Une fois nos cellules saturées, il faut les marquer.
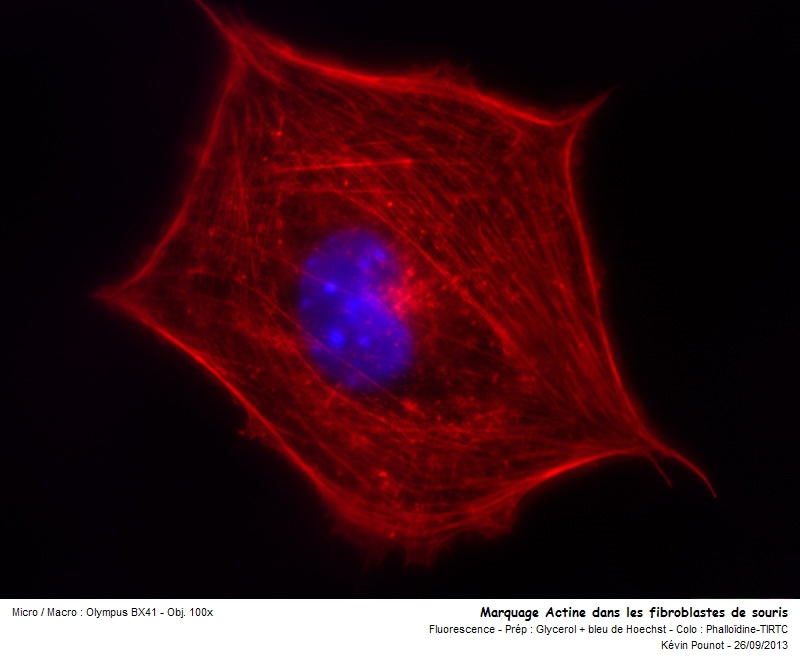
Concernant le marquage de l'actine, c'est très simple, on utilise la phalloïdine-tétrarhodamineisothiocyanate, un composé extrait de l'Amanite phalloïde et qui se lie spécifiquement à l'actine.
Elle donne une couleur rouge lorsqu'elle est excitée.
Concernant nos immunomarquages, on utilise d'abord des anticorps primaires obtenus en exposant des animaux à notre protéine - un antigène - inactivée, l'animal produit alors des anticorps qui sont récupérés.
Ensuite, on utilise des anticorps secondaires qui eux, sont spécifiques des premiers anticorps. De plus, ceux-ci portent aussi un marqueur fluorescent.
Ainsi, notre protéine d'intérêt est liée à l'anticorps primaire qui lui même est lié à l'anticorps secondaire qui porte le marqueur fluorescent. On rend donc indirectement notre protéine fluorescente.
Ici, on utilise comme marqueurs l'Alexa 488 qui colore en vert la vimentine et le Cyanine 3 qui colore en rouge les microtubules.
Cependant, que serait la science sans ses incontournables contrôles.
Il est en effet possible que malgré notre saturation, il y est encore des marquages non spécifiques.
Pour être sûrs que tout va bien, on fait un immunomarquage sur d'autres cellules mais avec des anticorps dirigés contre aucune protéines de nos cellules.
Ainsi, si il n'y a pas de liaison non spécifiques, ces anticorps sont éliminés pendant les lavages et aucune fluorescence n'apparait.
• Montage
Ca vous connaissez bien, on utilise du glycérol avec du bleu de Hoechst qui va rendre nos noyaux bleus en fluorescence.
Résultats
Et voici donc les photos obtenues avec un Olympus BX41 en épifluorescence.
Les deux premières images concernent l'immunomarquage, on observe la tubuline en rouge qui forme des microtubules partant du centre de la cellule et qui permettent de maintenir sa forme et qui participe aux transports intra-cellulaires.
La vimentine, verte mais jaune sur la photo à cause de la superposition des couleurs, forme des filaments qui entourent la membrane du noyau et qui maintient sa forme.
L'actine, en rouge sur la dernière photo, permet à la cellules d'être motile, c'est à dire de se déplacer, de s'étaler et de répondre aux signaux extérieurs.


Re: Marquages fluorescents dans des fibroblastes de souris
--
Christian
Saturday, 05 October 2013 23:01
Merci Kevin pour cet excellent article ! 
[quote="Christian"]
Merci Kevin pour cet excellent article ! 
[/quote]
Re: Marquages fluorescents dans des fibroblastes de souris
--
BelialL
Friday, 27 September 2013 20:13
La caméra utilisée une une Zeiss Axiocam, je ne sais plus laquelle exactement, mais ça doit valoir...
[quote="BelialL"]
La caméra utilisée une une Zeiss Axiocam, je ne sais plus laquelle exactement, mais ça doit valoir plutôt cher je crois... 
[/quote]
Re: Marquages fluorescents dans des fibroblastes de souris
--
Fredlab
Friday, 27 September 2013 16:35
Hello
"BelialL" wrote:
Les photos font 1388x1040 px en plein format, je peux te les envoyer en mp. 
Ca qui tendrait à dire qu'ils utilisent une camera à...
[quote="Fredlab"]
Hello
[quote="BelialL":2amd3lzz]Les photos font 1388x1040 px en plein format, je peux te les envoyer en mp.  [/quote:2amd3lzz]
Ca qui tendrait à dire qu'ils utilisent une camera à (relativement) faible résolution
une 1,4 Mpx ? quelle marque/modèle ? (une idée du prix ?)
Pour l'envoi des images, il faut voir - en MP, tu seras limité en taille (800 px ?)
ou alors tu l'héberge quelque part (Flickr) et tu me donnes les liens.
Merci en tout cas.

[/quote]
Re: Marquages fluorescents dans des fibroblastes de souris
--
KATZEN
Friday, 27 September 2013 13:21
Hello,
Splendides images....avec un BX41 à 12000 euros ! on est loin de nous pauvres amateurs avec nos vieux Leitz!
merci pour le partage, montre nous d'autres images pour nous faire rêver ! 
[quote="KATZEN"]
Hello,
Splendides images....avec un BX41 à 12000 euros ! on est loin de nous pauvres amateurs avec nos vieux Leitz!
merci pour le partage, montre nous d'autres images pour nous faire rêver ! 
[/quote]
Re: Marquages fluorescents dans des fibroblastes de souris
--
BelialL
Friday, 27 September 2013 11:21
Salut à tous,
"Fredlab" wrote:
Hello
Je vois que tu as eu une promotion -> un BX 41 - mazette 
Pourrais-tu m'envoyer les images en un peu plus grand, pour illustrer...
[quote="BelialL"]
Salut à tous,
[quote="Fredlab":2688ts3c]Hello
Je vois que tu as eu une promotion -> un BX 41 - mazette 
Pourrais-tu m'envoyer les images en un peu plus grand, pour illustrer quelques cours ?
(et si tu pouvais avoir des mitoses/méïoses avec le même genre de technique, je prends)
[/quote:2688ts3c]
J'aimerais bien ! Je leur ai demandé s'ils n'en avaient pas en trop, mais non... 
Les photos font 1388x1040 px en plein format, je peux te les envoyer en mp. 
[/quote]
|